(Zdroj foto: Adobestock.com)
Všetky lieky, ktoré sa v Európskej únii dostanú na trh, musia spĺňať tri dôležité vlastnosti – musia byť účinné, kvalitné a bezpečné. Tomuto pravidlu sa, samozrejme, nevymykajú ani biologické lieky.
Biologické lieky aj vzhľadom na svoje špecifiká, podliehajú mimoriadne prísnym požiadavkám na ich bezpečnosť. Pri správnom nastavení liečby a dodržiavaní pokynov lekára sa ich preto nemusíte obávať.
V čom sa biologické lieky líšia od chemických?
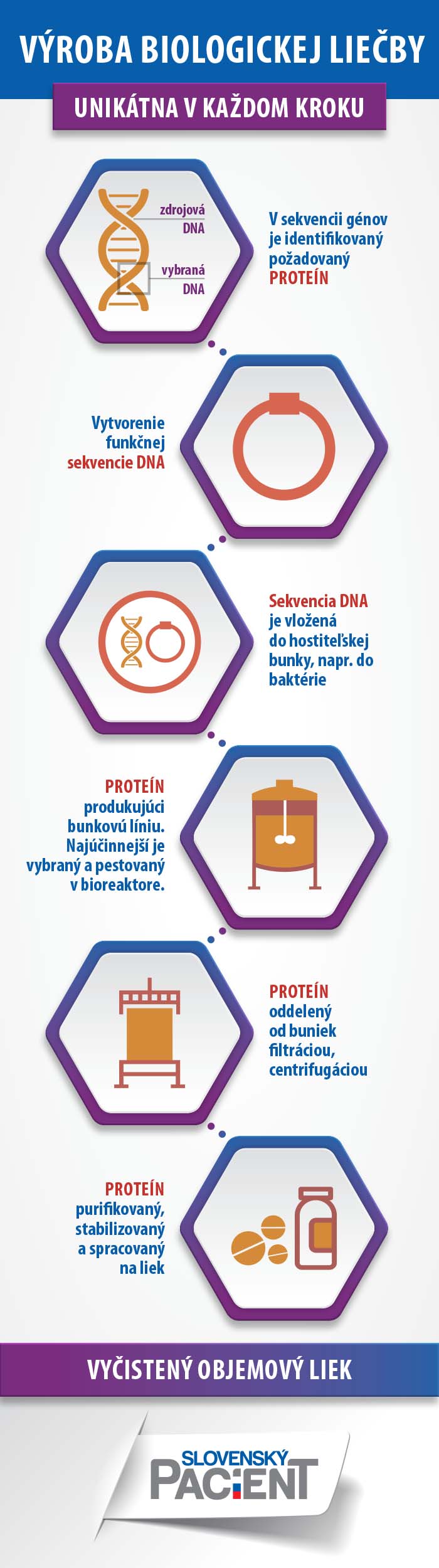
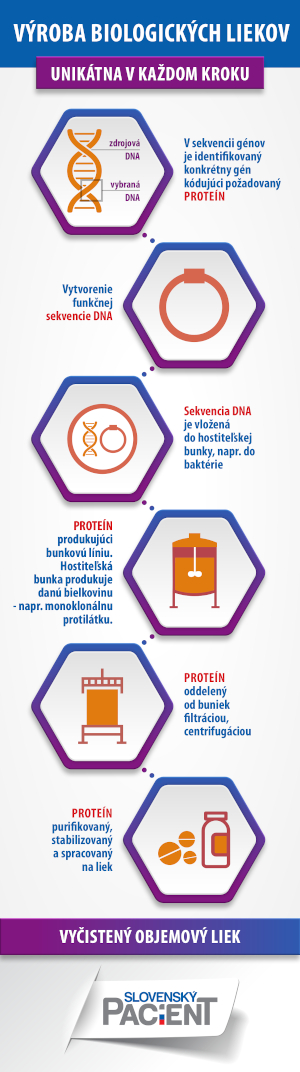
Ako sme písali v článku Čo tušíte a netušíte o biologickej liečbe, biologické lieky majú svoje špecifiká. Obsahujú totiž účinnú látku, ktorú vyprodukovali živé bunky alebo organizmy. Je ňou veľká molekula (najčastejšie bielkovina), čo ich zásadne odlišuje od malých, chemickým procesom vyprodukovaných liečiv.
Zo štruktúry biologických liekov vyplývajú určité vlastnosti, ktoré môžu mať vplyv aj na ich bezpečnosť. Tomu však zodpovedajú aj prísne bezpečnostné štandardy, ktoré sú pre tieto lieky nastavené. Tie sú dostatočnou zárukou toho, že lieky, ktoré sa dostanú k pacientom, sú dostatočne overené a bezpečné.
Základné špecifiká biologických liekov
Keďže základom biologických liekov sú živé organizmy, môže sa stať, že medzi jednotlivými šaržami liekov sa vyskytnú mikrorozdiely. Je to preto, lebo každý živý organizmus je unikátny a vo výrobnom procese túto unikátnosť nemožno obísť. Preto sa počas výrobného procesu vykonávajú pravidelne takzvané štúdie komparability (porovnateľnosti) pri zmenách výrobného procesu, aby sa preverilo, či sa medzi liekmi nevyskytli zásadnejšie rozdiely, ktoré by mohli ovplyvniť ich bezpečnosť.
Po vyhodnotení týchto dát, musí byť zároveň táto zmena vo výrobe vždy schválená príslušnou inštitúciou zodpovednou za dohľad nad liekmi. V tomto prípade je to Európska lieková agentúra (označovaná skratkou EMA).
Rovnaký proces platí aj pre biologicky podobné lieky alebo tzv. biosimilárne lieky. Tieto lieky sú vysoko podobné nejakému už existujúcemu biologickému lieku, ktorý je na trhu a úspešne sa používa – takzvaný referenčný biologický liek.
Medzi referenčným a biologicky podobným liekom sa tiež môže vyskytnúť mierna variabilita. Kontrolované štúdie komparability majú aj v tomto prípade za cieľ zaručiť porovnateľnú účinnosť a bezpečnosť biologicky podobného lieku s originálnym referenčným liekom.

Stretli ste sa už s výrazom imunogenita?
S výrazom imunogenita sa často môžete stretnúť práve v súvislosti s biologickými liekmi. Imunogenita je schopnosť účinnej látky vyvolať v tele imunitnú reakciu proti sebe samej. Je to však zároveň aj jednou z výziev, ktoré s biologickou liečbou súvisia.
Na jednej strane preto, lebo telo si proti lieku môže vytvoriť istú formu odolnosti – takzvané ADA protilátky (anti-drug antibodies) a tie môžu znížiť účinnosť lieku alebo jej úplne zabrániť. Niekedy sa tieto protilátky označujú aj ako inhibítory.
Na druhej strane sa imunogenita spája aj s niektorými vedľajšími účinkami imunitného charakteru. Môže sa prejaviť alergickými reakciami, anafylaxiou (silná generalizovaná, potenciálne život ohrozujúca alergická reakcia sprevádzaná ťažkosťami s dýchaním, opuchom, nevoľnosťou a búšením srdca) či zníženým počtom krvných doštičiek.
Príčinou takýchto reakcií organizmu na biologickú liečbu môžu byť veľké molekuly účinnej látky, ktoré vedia imunitný systém zaktivizovať, ale aj fakt, že sa vyrábajú zo živých organizmov.
Imunogenita sa kontroluje
Imunogenita je ale, samozrejme, pri biologických liekoch vždy kontrolovaná, aby sa k vám nedostal liek, ktorý by mohol byť nebezpečný. Uvedeniu každého jedného biologického lieku na trh preto predchádzajú rozsiahle klinické skúšania, ktoré skúmajú nielen krátkodobé, ale aj dlhodobé reakcie imunitného systému na liečbu.
Výsledky skúšaní posudzujú liekové autority, ktoré aj pri najmenšej pochybnosti o účinnosti a bezpečnosti lieku môžu proces výroby a schvaľovania lieku zastaviť. Výrobca buď musí na požiadanie liekovej agentúry doložiť ďalšie dôkazy o účinnosti a bezpečnosti lieku, alebo sa takýto liek vôbec nemusí dostať na trh.
Udáva sa vo všeobecnosti, že z 5000 molekúl liekov skúmaných v predklinických štúdiách prejde do klinického skúšania u ľudí len 5 molekúl, z ktorých sa následne do reálnej klinickej praxe dostane len 1! Tým je zaručený optimálny pomer medzi účinnosťou a bezpečnosťou a zároveň dochádza k vyselektovaniu len tých najlepších molekúl.
Monitorovanie lieku pokračuje aj po uvedení lieku do obehu. Jeho cieľom je zabezpečiť, aby sa v procese používania lieku nevyskytli žiadne výnimočné alebo zriedkavé reakcie na liečbu. Vďaka týmto opatreniam je realita v praxi taká, že imunogenita sama osebe nepredstavuje bezpečnostné riziko pre pacientov. Prípadná imunitná odpoveď voči lieku nemá zvyčajne závažné klinické prejavy, prípadne sa vyskytujú veľmi zriedka.
Pri správnom nastavení liečby a spolupráci medzi lekárom a pacientom sa však aj takéto prípady dajú zvládnuť bez zásadných problémov. Okrem toho sa aj jednotlivé molekuly biologík líšia stupňom imunogenity, čo možno vytušiť už aj z názvu samotnej molekuly – imunogenita klesá od prípavkov s –chi/xi- v názve, cez –zu- až po najmenej imunogénne molekuly, ktoré majú v názve svojej molekuly slabiku –mu-. Tieto slabiky vyjadrujú pôvod a zloženie samotnej molekuly a ich podobnosť s prirodzenými molekulami v ľudskom organizme.

Biologické lieky a vedľajšie účinky
Tak ako všetky iné lieky, aj biologické lieky môžu vyvolať určité vedľajšie účinky. Tie sa u vás môžu, ale aj vôbec nemusia prejaviť. Je dôležité si uvedomiť, že v príbalovej informácii k lieku musia byť uvedené všetky vedľajšie účinky, ktoré sa pri ich podávaní doposiaľ objavili, ale to neznamená, že sa automaticky objavia aj u vás.
Väčšina vedľajších účinkov vychádza z mechanizmu pôsobenia daného lieku. Napríklad lieky s látkou epoetín, ktoré sa používajú na liečbu anémie, teda chudokrvnosti, môžu spôsobiť zvýšené hladiny hemoglobínu a s tým súvisiace napr. poruchy krvného obehu.
Pri liečivách na potláčanie imunity, ktoré sa používajú pri autoimunitných ochoreniach, sa niekedy môžu vyskytnúť aj na pohľad závažnejšie vedľajšie účinky, ako napríklad tuberkulóza. Samotné liečivo, samozrejme, tuberkulózu nevyvolá, avšak potlačením imunity sa človek môže stať náchylnejším na okolité infekcie.
V každom prípade však platí, že všetky lieky, ktoré sa dostanú k pacientovi, prešli rozsiahlymi skúšaniami, testami a posudzovaním. Jednoznačne museli preukázať, že výhody lieku mnohonásobne prevyšujú akýkoľvek jeho potenciálny nežiadúci vedľajší účinok.
Dohľad nad bezpečnosťou liekov prebieha aj po ich uvedení na trh
Úspešné využívanie biologických liekov v praxi je možné aj vďaka komplexnému systému monitorovania ich bezpečnosti. Lieky ostávajú neustále sledované počas celého ich životného cyklu. Takýto sústavný dohľad nad liekmi na nazýva farmakovigilancia. Tento proces dokáže odhaliť aj veľmi zriedkavé vedľajšie účinky, čo je možné len pri veľkom počte liečených ľudí.
Informácie o bezpečnosti liekov sa tak neustále aktualizujú na medzinárodnej úrovni a v prípade, že by nejaký liek prestal spĺňať prísne bezpečnostné požiadavky, kompetentné liekové autority ho môžu kedykoľvek stiahnuť z trhu.
Bezpečnosť liekov je prvoradá
Biologické lieky sú novým, revolučným prístupom k liečbe niektorých ochorení, ktoré boli predtým veľmi ťažko liečiteľné až neliečiteľné. Samozrejme je veľmi dôležité, aby tieto lieky v prvom rade pomáhali, a preto sa kladie mimoriadne vysoký dôraz na ich bezpečnosť. Preto, aj keď možno s biologickými liekmi zatiaľ skúsenosť nemáte, resp. máte s nimi menej skúseností ako s tradičnými chemickými liekmi – veď kto z nás už niekedy neužil lieky s účinnými látkami ibuprofén alebo paracetamol proti bolesti – určite sa ich nemusíte obávať z dôvodu bezpečnosti. O tú sa denne starajú národné aj nadnárodné liekové agentúry, odborníci, ale aj samotní výrobcovia.
Autorka je farmaceutka
Bibliografia :
Biosimilars in the EU, Information guide for healthcare professionals, Prepared jointly by the European Medicines Agency and the European Commission, 2017
Identification and traceability of biological products, Dr. Peter de Veene,
Kraljevic S. a kol. Accelerating drug discovery. EMBO Rep 2004;5:837-842.
Quick Guide on Bilogical and Biosimilar Medicine, International Alliance of Patients´ Organizations, 2013